UNI EN 14683:2019 | Requisiti maschere facciali uso medico (cd "chirurgiche")
ID 10435 | Rev. 2.0 del 26.03.2020
Il presente documento riporta i requisiti per la costruzione, la progettazione delle maschere facciali ad uso medico (cd “mascherine chirurgiche”) destinate a limitare la trasmissione di agenti infettivi dal personale ai pazienti durante le procedure chirurgiche e altre attività mediche con requisiti simili. Le mascherine devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745.
Con il decreto legge 17 marzo 2020 n. 18, all’art. 16 è riportato che sono considerati dispositivi di protezione individuale (DPI), di cui all’articolo 74, comma 1, del decreto legislativo 9 aprile 2008, n.81, le mascherine chirurgiche reperibili in commercio, il cui uso è disciplinato dall’articolo 34, comma 3, del Decreto-Legge 2 marzo 2020 n. 9.
Nella Rev. 2.0 è stato aggiunto:
- Percorso di Conformità per la Marcatura CE delle maschere facciali ad uso medico secondo quanto previsto dalla Direttiva 93/42/CEE.
- Note cap. 6.1 Mascherine MD usate come DPI.
Update 1.0 del 25.03.2020
Nella Rev. 1.0 è stato aggiunto il Percorso di Conformità per la Marcatura CE delle maschere facciali ad uso medico secondo quanto previsto dal Regolamento (UE) 2017/745 ed il modello di Dichiarazione di Conformità UE (Allegato IV Regolamento (UE) 2017/745).
Le maschere facciali ad uso medico devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745 (applicabile a decorrere dal 26 maggio 2020, entrato in vigore il 25 Maggio 2017).
Secondo quanto indicato nella Decisione di esecuzione (UE) 2020/437 la norma EN 14683:2019+AC:2019 dà la presunzione di conformità ai requisiti essenziali (Allegato I della Direttiva 93/42/CEE). La norma EN 14683:2019+AC:2019 non può al momento essere utilizzata per conferire una presunzione di conformità ai requisiti del Regolamento (UE) 2017/745 (Articolo 3 della Decisione di esecuzione (UE) 2020/437).
UNI EN 14683:2019 Maschere facciali ad uso medico - Requisiti e metodi di prova Data entrata in vigore: 30 ottobre 2019 Recepisce: EN 14683:2019+AC:2019 Le maschere facciali ad uso medico devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745 (applicabile a decorrere dal 26 maggio 2020, entrato in vigore il 25 Maggio 2017). La norma EN 14683:2019+AC:2019 non può al momento essere utilizzata per conferire una presunzione di conformità ai requisiti del Regolamento (UE) 2017/745 (Articolo 3 della Decisione di esecuzione (UE) 2020/437).
Le maschere facciali ad uso medico (cd - “chirurgiche”) possono anche essere destinate ad essere indossate dai pazienti e da altre persone per ridurre il rischio di diffusione delle infezioni, in particolare in situazioni epidemiche o pandemiche.
Fig. 1 - Esempio maschere facciali ad uso medico (cd “mascherine chirurgiche”)
Quando si respira, si parla, si tossisce, si starnutisce, ecc., si rilasciano piccole o grandi quantità di goccioline di secrezioni dalle mucose della bocca e del naso. La maggior parte dei nuclei ha un diametro compreso tra 0,5 μm e 12 μm e soprattutto le goccioline più grandi possono contenere microrganismi provenienti dal sito di origine. I nuclei possono successivamente diffondersi attraverso l'aria in un sito suscettibile come una ferita operatoria aperta o un’attrezzatura sterile.
Le maschere facciali ad uso medico destinate ad essere utilizzate in sale operatorie e in attività sanitarie con requisiti simili sono progettate per proteggere l'intero ambiente di lavoro. La presente norma descrive due tipi di maschere facciali ad uso medico con i relativi livelli di protezione. Come minimo, le maschere facciali ad uso medico di tipo I sono utilizzate per i pazienti al fine di ridurre il rischio di diffusione delle infezioni, in particolare in situazioni epidemiche o pandemiche. Le maschere di tipo II sono destinate principalmente all'uso da parte degli operatori sanitari in sala operatoria o in altre attività mediche con requisiti simili.
Un caso particolare, coperto anche dalla legislazione europea sui dispositivi medici, è quello in cui chi lo indossa desidera proteggersi da spruzzi di liquidi potenzialmente contaminati.
Il livello di efficienza offerto da una maschera dipende da una serie di fattori quali l'efficienza di filtrazione, la qualità del materiale e la vestibilità della maschera sul viso di chi la indossa. Progettazioni differenti sono idonee per applicazioni diverse e la scelta accurata della maschera è quindi importante per ottenere il risultato desiderato.
La capacità di filtrazione dei materiali della maschera può variare a seconda del materiale filtrante. La vestibilità delle maschere varia notevolmente da quelle che vengono tenute in posizione da anelli fissati dietro le orecchie di chi le indossa a quelle con fascette di fissaggio intorno alla testa e una fascetta per il naso che può essere modellata al naso di chi le indossa.
È usuale caratterizzare le prestazioni della maschera utilizzando prove in vitro del materiale di cui è fatta la maschera. Tuttavia, è importante considerare attentamente l'adattamento della maschera quando si sceglie una maschera per una determinata applicazione.
Un ulteriore fattore da considerare è la capacità della maschera di assorbire l'umidità dell'aria espirata e quindi di mantenere le sue prestazioni per un periodo di tempo più lungo. Le progettazioni più avanzate mantengono facilmente le loro prestazioni anche in caso di operazioni molto lunghe, mentre quelle meno avanzate sono destinate solo a procedure brevi.
Dato che le maschere usate sono considerate altamente contaminate, è essenziale che:
- il corpo della maschera non sia toccato dalle dita/mani di chi lo indossa;
- le mani siano disinfettate (disinfezione completa delle mani) dopo la rimozione della maschera;
- si indossi una maschera che copre il naso e la bocca di chi la indossa, in nessun momento una maschera sia appesa attorno al collo di chi la indossa;
- una maschera usata dovrebbe essere smaltita quando non è più necessaria o tra due procedure; quando c'è un'ulteriore necessità di protezione si dovrebbe indossare una nuova maschera.
________
1. Percorso di conformità Direttiva Dispositivi Medici 93/42/CEE
1.1 Entrata in vigore e applicazione
La Direttiva 93/42/CEE è stata attuata a seguito della pubblicazione nella Gazzetta Ufficiale Italiana n. 54, del 6 marzo 1997, del Decreto Legislativo N. 46 del 24 Febbraio 1997. La Direttiva 93/42/CEE è in abrogazione dal nuovo Regolamento (UE) 2017/745che si applica a decorrere dal 26 maggio 2020 (vedi tabella 1).
1.2 Classificazione dei dispositivi
Una volta stabilito che un prodotto è definibile come dispositivo medico, il fabbricante dovrà classificarlo in una delle classi di rischio stabilite dal decreto, al fine di attuare le procedure di valutazione della conformità previste per ciascuna classe.
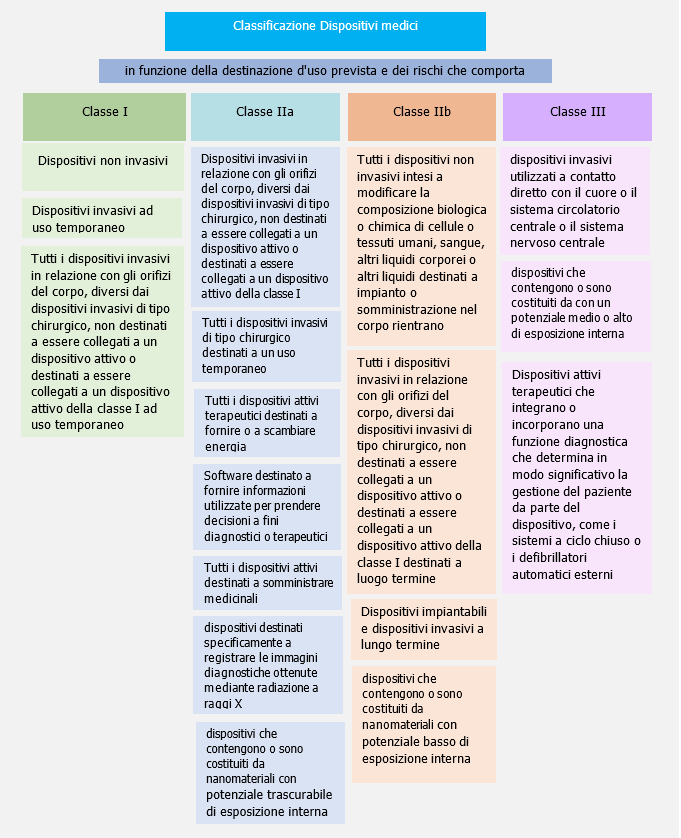
I dispositivi medici sono classificati in quatto classi di rischio crescente:
- Classe Is: dispositivi di classe I forniti allo stato sterile
- Classe Im: dispositivi di classe I che svolgono una funzione di misura.
Classe IIa: dispositivi a rischio medio, quali alcuni dispositivi non attivi (invasivi e non) e dispositivi attivi che interagiscono con il corpo in maniera non pericolosa.
Classe IIb: dispositivi a rischio medio/alto, quali alcuni dispositivi non attivi (specie invasivi) e i dispositivi attivi che interagiscono con il corpo in maniera pericolosa.
Classe III: dispositivi ad alto rischio, quali gran parte dei dispositivi impiantabili, quelli contenenti farmaci o derivati animali ed alcuni dispositivi che interagiscono sulle funzioni di organi vitali.
________
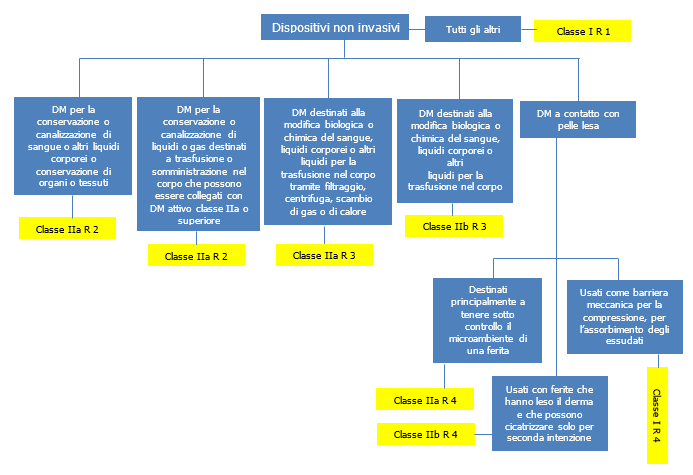
Fig. 2 – schema regole Direttiva 93/42/CEE dispositivi non invasivi
2. Percorso di conformità Regolamento (UE) 2017/745
2.1 Entrata in vigore e applicazione
________
2.2 Classificazione dei dispositivi
I dispositivi sono suddivisi nelle classi I, IIa, IIb e III, in funzione della destinazione d'uso prevista dei dispositivi e dei rischi che comporta.
La classificazione è effettuata conformemente all'allegato VIII, che tratta delle:
- Definizioni specifiche alle regole di classificazione
- Regole di applicazione
L'applicazione delle regole di classificazione si basa sulla destinazione d'uso dei dispositivi.
Se il dispositivo in questione è destinato a essere utilizzato in combinazione con un altro dispositivo, le regole di classificazione si applicano separatamente a ciascun dispositivo. Gli accessori per un dispositivo medico e per i prodotti elencati nell'allegato XVI sono classificati separatamente dal dispositivo con cui sono impiegati.
Il software destinato a far funzionare un dispositivo o a influenzarne l'uso rientra nella stessa classe del dispositivo.
Se il software non è connesso con nessun altro dispositivo, è classificato separatamente.
Se il dispositivo non è destinato a essere utilizzato esclusivamente o principalmente in una determinata parte del corpo, è considerato e classificato in base all'utilizzo più critico specificato.
Se diverse regole o, nell'ambito della stessa regola, più sottoregole si applicano allo stesso dispositivo in base alla sua destinazione d'uso, si applicano la regola e sottoregola più rigorose che comportano la classificazione più elevata.
Regole di classificazione per:
- dispositivi non invasivi
- dispositivi invasivi
- dispositivi attivi
- regole speciali
Le maschere facciali ad uso medico sono dispositivi medici non invasivi di Classe I.
Schema. 2
4. Classificazione
Le maschere facciali ad uso medico specificate nella presente norma europea sono classificate in due tipi (Tipo I e Tipo II) secondo l'efficienza di filtrazione batterica, mentre il Tipo II è ulteriormente suddiviso a seconda che la maschera sia resistente o meno agli spruzzi. La "R" indica la resistenza agli spruzzi.
Tabella 10 UNI EN 14683:2019 - Requisiti di prestazione per le maschere facciali ad uso medico
Fig. 6 - Sigla R "Resistenza spruzzi"
5. Requisiti
Materiali e costruzione
La maschera facciale ad uso medico è un dispositivo medico, generalmente composto da uno strato filtrante che viene posizionato, incollato o modellato tra gli strati di tessuto. La maschera facciale ad uso medico non deve disintegrarsi, rompersi o strapparsi durante l'uso previsto. Nella scelta dei materiali del filtro e dello strato, si deve prestare attenzione alla pulizia.
Progettazione
La maschera facciale ad uso medico deve essere fatta in modo da consentire di essere applicata strettamente sopra il naso, la bocca e il mento di chi la indossa e da assicurare che la maschera aderisca strettamente ai lati.
Le maschere facciali ad uso medico possono avere forme e costruzioni diverse, oltre a caratteristiche aggiuntive come uno schermo facciale (per proteggere chi lo indossa da spruzzi e gocce) con o senza funzione antiappannamento, o un ponte nasale (per migliorare la vestibilità conformandosi ai contorni del naso).
Efficienza di filtrazione batterica (BFE)
Se sottoposta a prova in conformità all'appendice B della norma tecnica UNI EN 14683:2019, la BFE della maschera facciale ad uso medico deve essere conforme al valore minimo indicato per il tipo pertinente nella tabella 1.
Per le maschere spesse e rigide, come le maschere rigide a becco d'anatra o a coppa, il metodo di prova può non essere idoneo in quanto non è possibile mantenere una tenuta adeguata nell’impattatore a cascata. In questi casi, per determinare il BFE si deve utilizzare un altro metodo equivalente valido.
Quando una maschera è composta da due o più aree con caratteristiche diverse o con una diversa composizione di strati, ogni pannello o area deve essere sottoposto a prova individualmente. Il pannello o l'area con le prestazioni più basse deve determinare il valore BFE della maschera completa.
Un provino del materiale della maschera è bloccato tra un impattatore a cascata a sei stadi e una camera per aerosol. Un aerosol di Staphylococcus aureus è introdotto nella camera per aerosol e fatto passare attraverso il materiale della maschera e l’impattatore sotto vuoto. L'efficienza di filtrazione batterica (BFE) della maschera è data dal numero di unità formanti colonie che attraversano il materiale della maschera facciale ad uso medico espresso come percentuale del numero di unità formanti colonie presenti nell'aerosol di prova.
________
6. Marcatura, etichettatura e imballaggio
L'allegato I della Direttiva concernente i dispositivi medici (93/42/CEE) o l'allegato I, del Regolamento (UE) 2017/745 relativo ai dispositivi medici specifica le informazioni che dovrebbero essere specificate sull’imballaggio in cui viene fornita la maschera facciale ad uso medico.
Devono essere fornite le seguenti informazioni:
a) numero della presente norma europea;
b) tipo di maschera (come indicato nella tabella 1).
Si dovrebbero considerare la EN ISO 15223-1:2016 e la EN 1041:2008+A1:2013.
Con il decreto legge 17 marzo 2020 n. 18, all’art. 16 è riportato che sono considerati dispositivi di protezione individuale (DPI), di cui all’articolo 74, comma 1, del decreto legislativo 9 aprile 2008, n.81, le mascherine chirurgiche reperibili in commercio, il cui uso è disciplinato dall’articolo 34, comma 3, del ddecreto-Legge 2 marzo 2020 n. 9.
...
Art. 34. Disposizioni finalizzate a facilitare l’acquisizione di dispositivi di protezione e medicali
1. Il Dipartimento della protezione civile e i soggetti attuatori individuati dal Capo del dipartimento della protezione civile fra quelli di cui all’ordinanza del medesimo in data 3 febbraio 2020 n. 630, sono autorizzati, nell’ambito delle risorse disponibili per la gestione dell’emergenza, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, ad acquisire dispositivi di protezione individuali (DPI) come individuati dalla circolare del Ministero della salute n. 4373 del 12 febbraio 2020 e altri dispositivi medicali, nonché a disporre pagamenti anticipati dell’intera fornitura, in deroga al decreto legislativo 18 aprile 2016, n. 50.
2. In relazione all’emergenza di cui al presente decreto, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, è consentito l’utilizzo di dispositivi di protezione individuali di efficacia protettiva analoga a quella prevista per i dispositivi di protezione individuale previsti dalla normativa vigente. L’efficacia di tali dispositivi è valutata preventivamente dal Comitato tecnico scientifico di cui all’articolo 2 dell’ordinanza del Capo del Dipartimento della protezione civile del 3 febbraio 2020, n. 630.
3. In relazione all’emergenza di cui al presente decreto, in coerenza con le linee guida dell’Organizzazione Mondiale della Sanità e in conformità alle attuali evidenze scientifiche, è consentito fare ricorso alle mascherine chirurgiche, quale dispositivo idoneo a proteggere gli operatori sanitari; sono utilizzabili anche mascherine prive del marchio CE previa valutazione da parte dell’Istituto Superiore di Sanità.
______
Decreto legge 17 marzo 2020 n. 18
...
Art. 16 (Ulteriori misure di protezione a favore dei lavoratori e della collettività)
1. Per contenere il diffondersi del virus COVID-19, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, sull’intero territorio nazionale, per i lavoratori che nello svolgimento della loro attività sono oggettivamente impossibilitati a mantenere la distanza interpersonale di un metro, sono considerati dispositivi di protezione individuale (DPI), di cui all’articolo 74, comma 1, del decreto legislativo 9 aprile 2008, n.81, le mascherine chirurgiche reperibili in commercio, il cui uso è disciplinato dall’articolo 34, comma3, del decreto-Legge 2 marzo 2020 n. 9.
Con il decreto legge 17 marzo 2020 n. 18, all’art. 15 è prevista la validazione straordinaria ed in deroga dei dispositivi di protezione individuale.
L’art. 15 del decreto legge n. 18 del 2020 detta disposizioni straordinarie per la gestione dell’emergenza Covid-19 e attribuisce all’Inail la funzione di validazione straordinaria e in deroga dei dispositivi di protezione individuale (DPI).
Art. 15 decreto legge n. 18 del 2020 (Disposizioni straordinarie per la produzione di mascherine chirurgiche e dispositivi di protezione individuale)
1. Fermo quanto previsto dall’articolo 34 del decreto-legge 2 marzo 2020, n. 9, per la gestione dell’emergenza COVID-19, e fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, è consentito produrre, importare e immettere in commercio mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni.
2. I produttori e gli importatori delle mascherine chirurgiche di cui al comma 1, e coloro che li immettono in commercio i quali intendono avvalersi della deroga ivi prevista, inviano all’Istituto superiore di sanità una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche delle mascherine e dichiarano che le stesse rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dalla citata autocertificazione le aziende produttrici e gli importatori devono altresì trasmettere all’Istituto superiore di sanità ogni elemento utile alla validazione delle mascherine chirurgiche oggetto della stessa. L’Istituto superiore di sanità, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza delle mascherine chirurgiche alle norme vigenti.
3. I produttori, gli importatori dei dispositivi di protezione individuale di cui al comma 1 e coloro che li immettono in commercio, i quali intendono avvalersi della deroga ivi prevista, inviano all’INAIL una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche dei citati dispositivi e dichiarano che gli stessi rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dalla citata autocertificazione le aziende produttrici e gli importatori devono altresì trasmettere all’INAIL ogni elemento utile alla validazione dei dispositivi di protezione individuale oggetto della stessa. L’INAIL, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza dei dispositivi di protezione individuale alle norme vigenti.
4. Qualora all’esito della valutazione di cui ai commi 2 e 3 i prodotti risultino non conformi alle vigenti norme, impregiudicata l’applicazione delle disposizioni in materia di autocertificazione, il produttore ne cessa immediatamente la produzione e all’importatore è fatto divieto di immissione in commercio.
Art. 16 (Ulteriori misure di protezione a favore dei lavoratori e della collettività)
1. Per contenere il diffondersi del virus COVID-19, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, sull’intero territorio nazionale, per i lavoratori che nello svolgimento della loro attività sono oggettivamente impossibilitati a mantenere la distanza interpersonale di un metro, sono considerati dispositivi di protezione individuale (DPI), di cui all’articolo 74, comma 1, del decreto legislativo 9 aprile 2008, n.81, le mascherine chirurgiche reperibili in commercio, il cui uso è disciplinato dall’articolo 34, comma3, del decreto-legge 2 marzo 2020, n. 9.
2. Ai fini del comma 1, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, gli individui presenti sull’intero territorio nazionale sono autorizzati all’utilizzo di mascherine filtranti prive del marchio CE e prodotte in deroga alle vigenti norme sull'immissione in commercio.
Per la procedura di richiesta produzione mascherine consultare: ISS | Procedure per richiesta produzione mascherine e Decreto Cura Italia: validazione straordinaria dei DPI (INAIL)
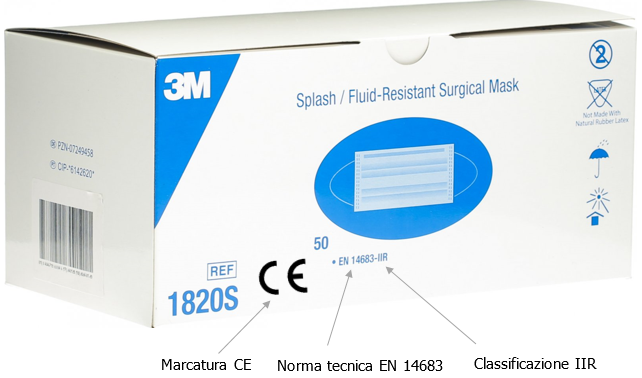
Fig. 8 - Esempio marcatura mascherine chirurgiche CE - EN 14683 - Classificazione IIR
...
segue in allegato
Fonti
UNI EN 14683:2019
Regolamento (UE) 2017/745
Certifico Srl - IT | Rev. 2.0 2020
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 2.0 | 26.03.2020 | Aggiornato con: - Direttiva 93/42/CEE - Note cap. 6.1 Mascherine MD usate come DPI |
Certifico Srl |
| 1.0 | 25.03.2020 | Aggiornato con Regolamento (UE) 2017/745 | Certifico Srl |
| 0.0 | 24.03.2020 | --- | Certifico Srl |
Collegati
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
Vademecum Mascherine COVID-19 VVF
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Rischio biologico Coronavirus | Titolo X D.Lgs. 81/08
DPCM 22 Marzo 2020
DPCM 11 marzo 2020
DPCM 9 Marzo 2020
DPCM 8 Marzo 2020
Nuovo Coronavirus: fonti di informazione
Protocollo Sicurezza luoghi di lavoro Covid-19