Conversione parti per milione (ppm) in mg/m3
ID 13140 | 24.03.2021 / Documento completo allegato
Documento di analisi sulla corretta modalità di conversione dell’unità di misura adimensionale parti per milione (ppm) in unità di misura dimensionali. Le concentrazioni delle soluzioni vengono spesso indicate in ppm (parti per milione), è utile, pertanto, conoscere le corrette modalità di conversione di questa unità di misura. In particolare il documento analizza la conversione in mg/m³ che, insieme all’unità di misura in ppm, rappresenta il modo più comune per indicare le concentrazioni di inquinanti solidi in forma gassosa (fumi).
Parti per milione (ppm) è una unità di misura adimensionale che indica un rapporto tra quantità misurate omogenee di un milione a uno. Ad esempio viene usata per livelli estremamente bassi di concentrazione di un elemento chimico, ma anche per esprimere errori di misurazione, o tolleranze. Il valore delle ppm è equivalente alla quantità assoluta frazionale moltiplicata per un milione (106).
Questa unità viene utilizzata per misurare:
- la concentrazione di sostanze inquinanti nell'ambiente;
- in chimica analitica, la concentrazione in genere di elementi in tracce;
- in ingegneria, la tolleranza di prodotti in serie, o l'errore associato a valori di riferimento, come ad esempio i campioni;
- nei prodotti di uso comune come nel dentifricio, per quantificare la concentrazione di ioni fluoro contenuti.
Formule per la conversione in mg/m³
Normalmente le sostanze inquinanti aerodisperse vengono misurate in ppm (parti per milione) se allo stato gassoso o in mg/m³ se si tratta di aerosol (o di fumi), specificando anche la percentuale di ossigeno presente in essi.
Per convertire dall'una all'altra unità di misura è sufficiente moltiplicare il valore in ppm per il peso molecolare (PM) della sostanza espressa in grammi e dividere tutto per 24,45 m3mol−1 (volume molare dell’aria a 25°C ed 1 atmosfera):
mg/m3 = (ppm x PM) / 24,45
oppure
mg/m3 = 0,0409 x ppm x PM
Se però la temperatura e la pressione hanno valori diversi bisogna prendere in considerazione la legge dei gas ideali PV=nRT da cui il volume molare dell‘aria è V=(RT/P) dove R è la costante del gas ideale, T la temperatura in Kelvin (273,16 + T °C), P la pressione in mmHg (millilitri di mercurio) e n (numero di moli)=1:
mg/m3 = (ppm x PM x P/RT)
Il valore di R è 62,4 quando la temperatura è in Kelvin (273,16 + T °C), la pressione in mmHg e il volume in litri. La costante del gas può avere valori diversi se la temperatura e la pressione sono espresse in unità diverse da quelle dell'equazione precedente.
Sulla base dei pesi molecolari e usando le formule precedenti è possibile determinare dei coefficienti di conversione da usare per passare da ppm a mg/m3 e viceversa.
La IUPAC (International Union of Pure and Applied Chemistry) ha fissato le condizioni di 0 °C (273,15 K, 32 °F) e 1 bar (105 pascal) come rappresentative delle condizioni in cui si trova normalmente una sostanza sulla Terra.
Esistono, comunque, altre condizioni di riferimento comunemente usate in chimica ed in fisica:
Standard Ambient Temperature and Pressure
Con il termine Standard Ambient Temperature and Pressure (o SATP), utilizzato in chimica, si indicano le condizioni generalmente a temperatura di 298,15 K (25 °C) e pressione di 100 kPa (1 bar).
International Standard Atmosphere
Con il termine International Standard Atmosphere (o ISA), utilizzato in aviazione, si indicano le condizioni a temperatura di 288,15 K (15 °C), pressione di 101,325 kPa (1 atm), e umidità 0,00.
Condizioni normali
Con l'indicazione condizioni normali (abbreviato in c.n. o NTP, dall'inglese Normal Temperature and Pressure), vengono intese delle condizioni convenzionali di temperatura e pressione. Esse tuttavia possono variare, a seconda della fonte consultata; valori comunemente impiegati sono 293,15 K (20 °C, 68 °F) e 101,325 kPa (1 atm)[2] o 273,15 K (0 °C, 32 °F) e 101,325 kPa (1 atm).
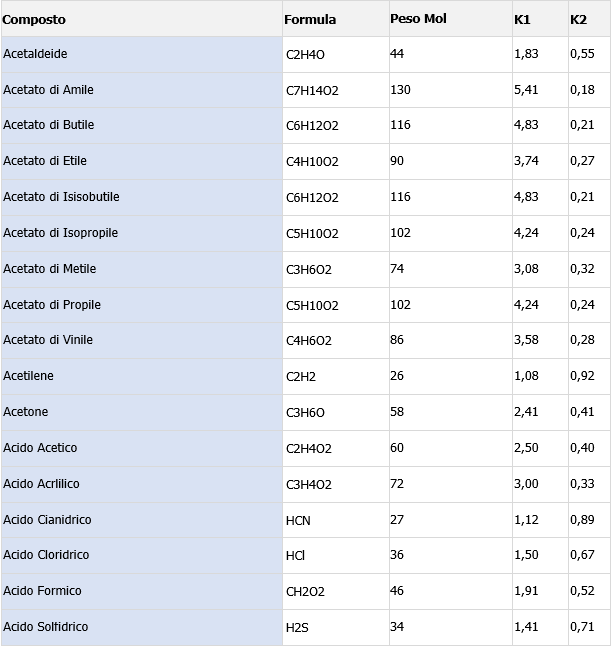
Coefficiente di conversione da ppm a mg/m3 (K1) con temperatura 20°C e pressione 760 mmHg
V = (62,4 x 273,16) / 760 = 24,06 m3mol−1
K1 X ppm = mg/m3 = 0,0415 x ppm x PM
K1 = 0,0415 x PM
Coefficiente di conversione da mg/m3 a ppm (K2) con temperatura 20°C e pressione 760 mmHg
V = (62,4 x 273,16) / 760 = 24,06 m3mol−1
K2 X mg/m3 = ppm = mg/m3 / (0,0415 x PM)
K2 = 1 / (0,0415 x PM)
Esempio tabella di conversione
...
Segue in allegato (Documento di completo)
Fonti
IUPAC (International Union of Pure and Applied Chemistry)
D.Lgs. 81/08
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 0.0 | 24.03.2021 | --- | Certifico Srl |
Collegati